Rationaler Antibiotikaeinsatz durch Information und Kommunikation: projekt
Das Modellprojekt «Rationaler Antibiotikaeinsatz durch Information und Kommunikation» (RAI) ist ein Basisprojekt des Konsortiums InfectControl im Rahmen der Fördermaßnahme «Zwanzig20 – Partnerschaft für Innovation» des Bundesministeriums für Bildung und Forschung (BMBF). InfectControl 2020 hat sich die Entwicklung, Validierung und Umsetzung neuer Strategien zur Infektionsbekämpfung zum Ziel gesetzt.
RAI zeichnet sich dadurch aus, dass sich erstmals in Deutschland sektorenübergreifend Human- und Tiermediziner gemeinsam mit Designern und Kommunikationsexperten in einem Projektverbund dem Thema Antibiotikaeinsatz und Resistenzentwicklung gewidmet haben. Das Projekt läuft seit 2015. Hier können Sie sich eine kurze Projektbeschreibung downloaden. Die verschiedenen Teilprojekte sind weitgehend abgeschlossen.
Das gemeinsame Ziel aller Projektpartner war es, die Resistenzentwicklung einzudämmen bzw. zu verlangsamen. Dafür wurden Botschaften und Interventionswerkzeuge (Tools) spezifisch auf die verschiedenen Akteure zugeschnitten und auf deren Bedürfnissen angepasst. RAI hat dazu von Projektstart an die verschiedenen Akteursgruppen durch qualitative und quantitative Methoden in die Tool-Entwicklung mit einbezogen.
Wer wird angesprochen?
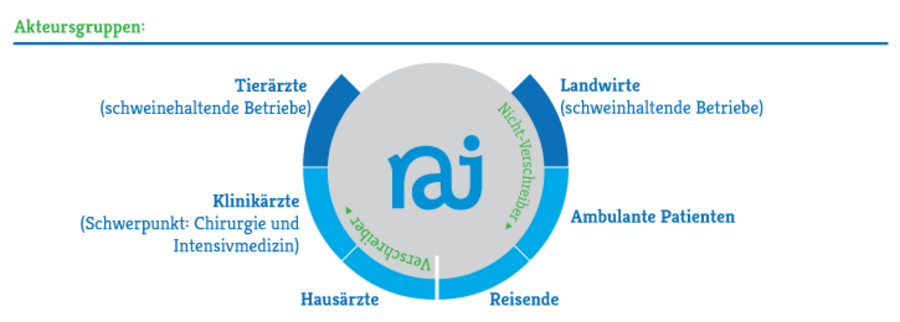
Basierend auf dem Gedanken des One Health-Konzepts bindet RAI die verschiedenen Akteure mit ein. Adressiert werden auf Seite der Verordnenden Hausärzt:innen, Tierärzt:innen, Chirurg:innen und Intensivmediziner:innen, auf der Seite der Anwendenden vor allem ambulante Patient:innen, Betreiber:innen von schweinehaltenden Betrieben, die Allgemeinbevölkerung im Sinne von potentiellen Patient:innen sowie Fernreisende.
2019 ist mit dem Anschlussprojekt RAI students die neue Zielgruppe der Medizinstudierenden hinzu gekommen.
Auf diesen Seiten finden Sie die entwickelten Tools für Hausärzt:innen, Klinikärzt:innen, Tiermediziner:innen und Landwirt:innen sowie für Studierende der Medizin.
Wer war beteiligt?
Beteiligte Projektpartner des RAI-Basisprojekts:
-
CUMB: Charité, Institut für Hygiene und Umweltmedizin: Prof. P. Gastmeier - Dr. S. Schneider - Dr. F. Salm - Dr. M. Behnke - W. Wetzker - A. Gropmann - Dr. T. Kramer - PD Dr. C. Remschmidt - Dr. F. Schwab - Ch. Schröder
-
FUVM: Freie Universität Berlin, Institut für Mikrobiologie und Tierseuchen: Prof. L. Wieler (jetzt RKI) - Dr. A. Lübke-Becker - Dr. Szilvia Vincze (jetzt BfR) - Dr. Esther-Maria Antão (jetzt RKI)
-
FUPK: Freie Universität Berlin, Institut für Publizistik und Kommunikationswissenschaft: Prof. M. Lehmkuhl (jetzt KIT) - Dr. E. Boklage (RKI) - Prof. J. Trebbe - Prof. J. Raupp
-
UKJI: Universitätsklinikum Jena, Zentrum für Infektionsmedizin und Krankenhaushygiene: Prof. M. Pletz - PD Dr. S. Hagel - Dr. A. Moeser
-
UKJA: Universitätsklinikum Jena, Institut für Allgemeinmedizin: Prof. J. Bleidorn - Prof. Jochen Gensichen (jetzt LMU) - Dr. Inga Petruschke - Dr. K. Schmücker
-
RKI: Robert Koch-Institut, Fachgebiet 37: Dr. T. Eckmanns - Dr. M. Abu-Sin - Dr. J. Walter - A. Klingeberg
-
LG: Lindgrün GmbH: R. Hanke - W. Hanke - L. Klimmek - U. Kraft

Beteiligte Projektpartner des Folgeprojekts RAI students:
-
CUMB: Charité, Institut für Hygiene und Umweltmedizin: Prof. P. Gastmeier – Dr. Miriam Wiese-Posselt - Dr. S. Schneider – Clara Bergmann – Felicia Becker – Dr. Vitali Matyash
-
IHM: Julius-Maximilians-Universität Würzburg, Institut für Hygiene und Mikrobiologie: Prof. Dr. Oliver Kurzai - Dr. Thiên-Trí Lâm
-
TU-HC: Technische Universität Berlin, Institut für Psychologie und Arbeitswissenschaft – Fachgebiet Arbeitswissenschaft: Prof. Dr. Markus Feufel – Alina Röri
Perspektiven der Arbeitsschwerpunkte
In einem interdisziplinären, transsektoralen Projekt gibt es ganz unterschiedliche Perspektiven auf das Thema multiresistente Erreger und den Einsatz von Antibiotika, geprägt durch den jeweiligen Tätigkeitsbereich. Im Folgenden finden Sie Interviews, die zu Projektstart des Basisprojektes 2015 mit verschiedenen Beteiligten geführt wurden
Interview mit Prof. Petra Gastmeier, Direktorin des Instituts für Hygiene und Umweltmedizin der Charité Universitätsmedizin Berlin, das gleichzeitig als Nationales Referenzzentrum für die Surveillance von nosokomialen Infektionen fungiert.
Frau Gastmeier, Sie haben sich schon als Medizinstudentin entschieden, Fachärztin für Hygiene und Umweltmedizin zu werden – ein unter angehenden Ärzten eher ungewöhnlicher Berufswunsch. Wie kam es dazu?
Ich wollte weder den ganzen Tag nur im Labor stehen noch ausschließlich in der Patientenversorgung arbeiten, sondern eine Mischung. Dass Hygiene und Umweltmedizin ein sehr breites Gebiet bilden, hat mich deshalb sofort fasziniert. Man hat mit so vielen Dingen zu tun, mit Umweltuntersuchungen, mit gesunden und kranken Menschen, mit epidemiologischen Daten, mit Krankheitserregern, mit Public-Health-Aspekten. Das fand ich bereits im Studium spannend – und daran hat sich bis heute nichts geändert.
Seit 2008 leiten Sie das Institut für Hygiene und Umweltmedizin der Charité. Was genau machen Sie und ihre Kollegen dort?
Das Institut ist in erster Linie auf die Krankenhaushygiene und die Infektionsprävention fokussiert, die Umweltmedizin spielt inzwischen keine sehr große Rolle mehr. Unsere Hauptaufgabe besteht also darin, bei den Patienten der Charité Infektionen zu verhindern. Dabei haben wir mit allen Aspekten der Infektionsprävention zu tun, vom richtigen Umgang mit infektiösen Patienten über die Erstellung von Hygieneplänen bis hin zur Beratung bei Baumaßnahmen.
Gilt das nur für Ihr Institut oder ist es generell so, dass Hygieneexperten vor allem in Krankenhäusern arbeiten?
Der Schwerpunkt liegt eindeutig auf dem Bereich Krankenhaus, denn dort haben die Patienten ein besonders hohes Infektionsrisiko. Am höchsten ist es auf der Intensivstation, bei den Neugeborenen und bei immunsupprimierten Personen. In diesen Bereichen hat man als Krankenhaus-Hygieniker am meisten zu tun, weil Infektionen für die Patienten auch besonders gefährlich sind. Wenn ein beatmeter Patient auf der Intensivstation eine Blutstrominfektion bekommt, kann das schwerwiegende Folgen haben.
Wie groß ist denn die Gefahr, bei einem Krankenhausaufenthalt an einer schweren Infektion zu erkranken?
Wir gehen davon aus, dass in Deutschland jährlich 400.000 bis 600.000 Patienten eine Krankenhausinfektion erleiden. Die Zahlen kommen aus einer nationalen Prävalenzstudie von 2011, sind also relativ aktuell. Die Hälfte dieser Infektionen hat jedoch eher geringe Konsequenzen, weil es sich beispielsweise um eine oberflächliche Wundinfektion handelt, die sich meistens schnell wieder beheben lässt. Schwerere Infektionen – also die zweite Hälfte – sind keineswegs immer lebensbedrohlich, schaden dem Patienten aber stets, weil es ihm schlechter geht und er länger im Krankenhaus bleiben muss. Was auch schlecht für die Klinik ist, weil dadurch die Kosten steigen. Es lohnt sich also für Patient und Krankenhaus, nosokomiale Infektionen von vornherein zu verhindern.
Wie das geht und welche Maßnahmen dafür notwendig sind, teilen Sie und Ihre Kollegen aus der Hygiene dann den Ärzten in der Klinik mit. Stößt man dabei immer auf offene Ohren?
Es passiert schon ab und an, dass Ärzte und Pflegepersonal sich kritisiert und persönlich angegriffen fühlen, wenn wir Hinweise für die Verbesserung geben. Deshalb erfordert die Arbeit als Krankenhaus-Hygieniker auch diplomatisches Geschick. Allerdings hat sich da vieles zum Guten gewendet. Vor 20 Jahren herrschte eher ein Klima der Intransparenz. Man wollte die Infektionsraten einer Abteilung nicht wissen und schon gar nicht publik machen. Heute ist den Ärzten klar, dass die Erfassung der Infektionsfälle ein wichtiger erster Schritt für die Prävention ist. Deshalb gehen sie offen damit um und nehmen unsere Hilfe gern in Anspruch, um die Zahl der Infektionen möglichst gering zu halten. Wir Hygieniker werden nicht mehr als Polizei wahrgenommen, sondern als Ratgeber.
Mit RAI ist Ihr Institut federführend an einem Projekt beteiligt, bei dem es um den rationalen Einsatz von Antibiotika geht. Also um die Therapie von Infektionen, für die Hygieniker eigentlich gar nicht zuständig sind. Wie kam es dazu?
Es stimmt schon, der Hygieniker ist der Experte für die Prävention von Infektionen, um deren Behandlung kümmern sich dann andere Ärzte. Bei RAI geht es aber primär darum, die Zunahme von Bakterien, die gegen mehrere Antibiotika unempfindlich sind, einzudämmen. Da haben wir Krankenhaus-Hygieniker den besten Überblick über das Ausmaß des Problems, weil wir ständig mit Patienten zu tun haben, die von Infektionen mit diesen multiresistenten Erregern betroffen sind. Als Nationales Referenzzentrum für nosokomiale Infektionen haben wir ja zudem die Gesamtsicht und wissen, dass sechs Prozent aller Krankenhausinfektionen durch solche MRE bedingt sind. Wenn man diese Infektionen von vornherein verhindert, was ja unsere Kernkompetenz ist, muss man weniger Antibiotika geben. Und möglichst wenig Antibiotika einzusetzen ist das beste Mittel gegen die Resistenzentwicklung.
Sind die multiresistenten Erreger (MRE) nur im Krankenhaus ein Problem?
Infektionen MRE gibt es auch im ambulanten Bereich. Sie werden aber kaum festgestellt, da niedergelassene Ärzte bei Patienten mit Infektionen nur selten eine mikrobiologische Diagnostik veranlassen. Im Krankenhaus hingegen wird das gemacht, so entdeckt man die MRE. Und weil man die <acronym title="Multiresistente Erreger">MRE</acronym> dort primär identifiziert, denken viele Menschen, dass die Krankenhäuser an der Resistenz-Problematik schuld sind. Tatsächlich werden aber 80 bis 90 Prozent der multiresistenten Erreger von den Patienten ins Krankenhaus mitgebracht. Die Erreger leben zum Beispiel auf ihrer Haut oder im Darm, meist ohne dass das irgendwelche Folgen hat.
Wenn diese Erreger aber eine Infektion verursachen, dürften die Folgen umso gravierender sein. Denn in dem Fall wirken Antibiotika ja nicht mehr?
In der Öffentlichkeit wird zwar oft gesagt, dass bei Infektionen mit multiresistenten Erregern kein Antibiotikum mehr greift. Aber das stimmt so nicht. Bei den meisten MRE gibt es noch eine ganze Reihe Antibiotika, die man einsetzen kann. Sie haben aber oft mehr Nebenwirkungen als die gängigen Substanzen und sind auch teurer. Allerdings finden wir in den letzten zwei, drei Jahren tatsächlich immer häufiger Bakterien, die gegen alle gängigen Antibiotika-Klassen resistent sind. Besonders die Bakterien, bei denen das Enzym Carbapenemase auftritt, bereiten uns wirklich Kopfschmerzen.
Wäre es nicht die einfachste Lösung, neue Antibiotika zu entwickeln?
Neue Antibiotika-Klassen auf den Markt zu bringen, wird bestimmt noch zehn Jahre dauern. Deshalb ist es enorm wichtig, bis dahin die Ressourcen, die uns zur Verfügung stehen, so gut wie möglich zu nutzen. Das bedeutet, dass wir die vorhandenen Antibiotika vernünftiger einsetzen müssen – und das in allen Bereichen. Also nicht nur im Krankenhaus, sondern ebenso in der ambulanten Patientenversorgung, in der Tiermedizin und in der Landwirtschaft.
Wurden deshalb bei RAI Vertreter aus all diesen Bereichen an einen Tisch geholt?
Im Kampf gegen Antibiotikaresistenzen sitzen wir alle in einem Boot. Um beim rationalen Einsatz von Antibiotika voran zu kommen und die Resistenzentwicklung einzudämmen, müssen wir gemeinsam etwas unternehmen. Und genau das verkörpert RAI mit seinem interdisziplinären Ansatz.
Welche Rolle nimmt das Institut für Hygiene und Umweltmedizin in dem Projekt ein?
Unser Institut hat eine koordinierende Funktion. Es geht bei RAI ja darum, dass in allen Bereichen etwas getan wird und dass diese Aktivitäten auch abgestimmt laufen. So wird für jeden der Sektoren zunächst ermittelt, welche Hürden es beim rationalen Antibiotikaeinsatz und in der Kommunikation dieses Themas gibt. Da diese Barrieren sich unterscheiden, werden dann für die einzelnen Zielgruppen spezifische Kommunikations- und Informationsstrategien entwickelt – jeweils angepasst an deren Bedürfnisse. So wollen wir erreichen, dass es beim Umgang mit Antibiotika wirklich auf sämtlichen Ebenen voran geht.
Gibt es denn ganz konkrete Erfolgskriterien für das Projekt?
In den Modellregionen Berlin, Brandenburg und Thüringen ermitteln wir den Antibiotikaverbrauch, der am Ende der Projektlaufzeit geringer sein sollte als heute. Daten zu Antibiotikaresistenzen werden ebenfalls erfasst und ausgewertet. Ähnlich wichtig – und damit ein weiteres Erfolgskriterium – ist, dass das Wissen über Antibiotika und deren richtige Verwendung besser geworden ist. Nicht nur bei den verordnenden Ärzten und Tierärzten, sondern in der gesamten Bevölkerung. In den skandinavischen Ländern beispielsweise kennen sich die Menschen da wesentlich besser aus. Anders als bei uns weiß dort eigentlich jeder Erwachsene, dass eine echte Grippe durch Viren ausgelöst wird und es deshalb nichts bringt, ein Antibiotikum einzunehmen. Solche Botschaften an möglichst viele Menschen zu vermitteln, gehört auch zu den Zielen von RAI.
Da haben Sie und Ihre Projektpartner sich ja einiges vorgenommen. Wie stehen die Chancen, dass RAI ein Erfolg wird?
Ich bin sehr zuversichtlich, dass wir mit RAI einiges erreichen können. Schon jetzt sehen wir, dass viele Leute mitmachen und offenbar großes Interesse besteht, mehr für einen rationalen Antibiotikaeinsatz zu tun. Mehr Interesse als wir eigentlich erwartet hatten. Und das ist doch ein sehr gutes Zeichen
Ein Interview mit Szilvia Vincze, Veterinärmedizinerin am Institut für Mikrobiologie und Tierseuchen der Freien Universität Berlin
Frau Vincze, was hat Sie als Tierärztin ans Institut für Mikrobiologie und Tierseuchen geführt?
Während eines sechswöchigen Praktikums am Institut für Parasitologie habe ich mich erstmals mit der Bearbeitung einer wissenschaftlichen Fragestellung aus der Tiermedizin beschäftigt. Dabei habe ich festgestellt, dass Forschungs- und Labortätigkeit sehr vielfältig und interessant ist – und mich deshalb entschieden, nach dem Uni-Abschluss am Institut für Mikrobiologie und Tierseuchen eine Doktorarbeit zu beginnen.
Forschung, Tierklinik, eigene Praxis –Veterinärmedizinern stehen viele verschiedene Berufswege offen. Welche Optionen werden denn am häufigsten genutzt?
Das Tiermedizinstudium und auch der Beruf des Tierarztes sind in der Tat sehr breit aufgestellt. Von den knapp 12.000 niedergelassenen Tierärztinnen und Tierärzten in Deutschland arbeitet etwa die Hälfte ausschließlich im Kleintierbereich. Rund 4.800 Kollegen sind in gemischten Nutz- und Kleintierpraxen tätig, knapp 1.200 in reinen Nutztierpraxen. Bei den Nutztierärzten gibt es in manchen Regionen einen Mangel, obwohl sie tendenziell besser verdienen als niedergelassene Kleintierärzte in der Stadt. Außerdem arbeiten viele Veterinäre – abseits von dem klassischen Berufsbild des praktizierenden Tierarztes – in der Forschung, im öffentlichen Dienst oder auch in der Industrie.
Was spricht denn dagegen, als Veterinär in den Nutztierbereich zu gehen? Oder andersrum gefragt, was spricht dafür?
Nutztierarzt zu sein ist mitunter harte körperliche Arbeit und mit dem Familienleben vergleichsweise schwer zu vereinbaren. Man ist viel im Auto unterwegs um verschiedene Tierbestände zu betreuen und man muss regelmäßig in Rufbereitschaft sein, auch nachts und an Wochenenden. Das schreckt den Nachwuchs, der ja in der Veterinärmedizin vor allem aus Frauen besteht, oft ab. Rauszufahren, zu den Landwirten zu gehen und nicht immer nur in der Praxis zu sitzen, ist aber auch der Reiz am Beruf des Nutztierarztes. Außerdem ist der Ansatz hier sehr viel pragmatischer als bei den Kleintieren. In der Nutztierpraxis geht es primär darum, die Tiere gesund zu halten, bis sie dem Schlachtprozess zugeführt werden.
Bei RAI fokussiert sich Ihr Institut auf Nutztiere – konkret auf die Schweinemast. Was genau möchten Sie in dem Projekt erreichen?
Ein Forschungsschwerpunkt des Instituts liegt schon länger auf der Untersuchung von Infektionserregern, die sowohl vom Tier auf den Menschen als auch umgekehrt übertragen werden können – sog. Zoonose-Erreger -und die zudem noch resistent gegen mehrere Antibiotika sind. Wo diese multiresistenten Erreger vorkommen, wie häufig sie sind, was die Resistenzen hervorruft und wie sie sich ausbreiten können – all das sind für uns relevante Fragestellungen. RAI ist trotzdem in gewisser Weise ein Pionierprojekt, da wir erstmals gemeinsam mit Kommunikationsdesignern und Sozialwissenschaftlern einen Ansatz erarbeiten wollen, der uns eine zielgerichtete Kommunikation der Ergebnisse und des Erkenntnisstandes ermöglicht.
Welche Bedeutung haben Infektionskrankheiten bei Lebensmittel-liefernden Tieren denn für die Landwirte?
Der Begriff Landwirtschaft macht schon deutlich, dass es sich um einen Wirtschaftszweig handelt. Es geht also darum, Gewinne zu erzielen. Und dafür ist es ganz entscheidend, dass die Tiere gesund sind. Oberstes Ziel des Landwirts ist also, dass die Mastschweine ohne gesundheitliche Probleme durch die Mastperiode kommen und die Zuchtsauen viele Ferkel erzeugen. Bakterielle Infektionskrankheiten treten aber natürlich auch bei Lebensmittel-liefernden Tieren auf und müssen dann entsprechend mit Antibiotika behandelt werden.
Führt der wirtschaftliche Druck nicht dazu, dass der Landwirt den Tierarzt drängt, lieber einmal zu viel ein Antibiotikum zu verschreiben als einmal zu wenig?
Der Tierarzt darf laut Gesetz nur dann ein Antibiotikum verschreiben, wenn er bei einem oder mehreren Tieren tatsächlich eine Infektion festgestellt hat. Der Einsatz von Antibiotika als Leistungsförderer bei klinisch gesunden Tieren wurde 2006 in Deutschland verboten. Ausdrücklich erlaubt ist jedoch die so genannte Metaphylaxe, also die vorsorgliche Mitbehandlung der gesamten Gruppe von z.B Schweinen in einer Bucht.
Können Sie genauer erklären, was es mit einer metaphylaktischen Behandlung auf sich hat?
Die in kleinen Gruppen gehaltenen Mastschweine leben in direktem Kontakt zueinander. Das hat zur Folge, dass auch unterschiedliche Erreger zwischen den einzelnen Tieren ausgetauscht werden. Deshalb kann man davon ausgehen, dass Tiere, die fortgeschrittene Symptome einer ansteckenden Infektionskrankheit wie beispielsweise einer bakteriellen Atemwegserkrankung aufweisen, diese Erreger bereits auf andere Tiere der Gruppe übertragen haben – auch wenn diese noch keine Symptome zeigen.
Das bedeutet, dass dann die gesamte Mastschweingruppe in dieser Bucht mit Antibiotika behandelt werden muss. Anders wenn nur ein Tier betroffen ist und die Symptome frühzeitig erkannt werden. Statt einer metaphylaktischen Behandlung der Gruppe sollte dieses Schwein dann isoliert und einzeln behandelt werden.
Wie läuft die Antibiotika-Gabe in einem Schweinemastbetrieb denn ab und von wem wird sie vorgenommen? Vom Tierarzt oder vom Landwirt?
Eine Besonderheit in der Schweinemast ist, dass die Tiere aus tierschutzrechtlichen Gründen in Gruppen gehalten werden. Fürs Tierwohl steht das außer Frage, da Schweine sehr gesellig sind. Wegen der relativ engen Buchten haben die Tiere so aber permanent Kontakt miteinander. Wenn bei einem Tier Anzeichen einer Infektionskrankheit auftreten – zum Beispiel Durchfall – kann man deshalb davon ausgehen, dass alle anderen Tiere ebenfalls mit dem Erreger infiziert sind, auch wenn sie bislang noch keine Symptome zeigen. Das bedeutet, dass dann die gesamte Mastschweingruppe in dieser Bucht mit Antibiotika behandelt werden muss.
Wie läuft die Antibiotikagabe in einem Schweinemastbetrieb denn ab und von wem wird sie vorgenommen? Vom Tierarzt oder vom Landwirt?
Ob eine Antibiotika-Therapie angezeigt ist, entscheidet ausschließlich der Tierarzt. Die Behandlung kann dann sowohl vom Veterinär als auch vom Landwirt durchgeführt werden. In jedem Fall muss der Tierarzt einen Antibiotika-Anwendungs- und Abgabebeleg ausfüllen. Bei Abgabe des Antibiotikums an den Landwirt wird dort unter anderem die Diagnose dokumentiert, welches Antibiotikum er abgibt und wie das Medikament verabreicht wird. Der Landwirt erhält also eine ganz konkrete Anleitung, wie er den Wirkstoff einsetzen muss. In der Schweinehaltung spielt neben der parenteralen Behandlung die orale Antibiotikagabe über das Futter oder das Trinkwasser eine wichtige Rolle.
Der Landwirt kann die Behandlung also selbständig durchführen. Worauf muss er dabei achten?
Die große Herausforderung bei der oralen Therapie ist, dafür zu sorgen, dass alle Schweine die erforderliche Menge des Wirkstoffs bekommen. Kranke Tiere fressen und trinken ja oft weniger als gesunde. Wird ihnen das Antibiotikum über das Futter oder das Wasser verabreicht, besteht die Gefahr, dass sie das Medikament nicht in ausreichend hoher Dosierung aufnehmen. Was nicht nur verhindert, dass die Tiere wieder gesund werden, sondern zudem die Entwicklung antibiotikaresistenter Erreger befördert. Im Idealfall sollte der Tierarzt deshalb die erste Antibiotikagabe gemeinsam mit dem Landwirt durchführen. Das empfiehlt auch der Leitfaden zur oralen Anwendung von Tierarzneimitteln im Nutztierbereich über das Futter oder das Wasser des Bundesministeriums für Ernährung und Landwirtschaft.
Landwirten in der Nutztierhaltung und den Veterinären, die deren Tiere betreuen, wird oft vorgeworfen, dass sie im Umgang mit Antibiotika zu leichtfertig sind, dass sie diese so wichtigen Medikamente nicht rational einsetzen und deshalb die Hauptschuld an der Resistenzproblematik tragen. Wie schätzen Sie als Tierärztin das ein?
Die Tiermedizin hat sicherlich ihren Anteil an der Entwicklung von Antibiotikaresistenzen. Denn den hat jeder, der diese Medikamente verschreibt beziehungsweise anwendet. Deshalb ist es natürlich ganz wichtig, dass Antibiotika in der Tierhaltung rational eingesetzt werden – genau wie bei menschlichen Patienten.
Gibt es deshalb bei RAI einen sektorenübergreifenden Ansatz?
Ganz genau. Ich verspreche mir viel davon, dass in vielen relevanten Bereichen geschaut und überlegt wird, wie man mit vielen kleinen Schritten etwas gegen die Entwicklung und Ausbreitung resistenter Erreger unternehmen kann. RAI untersucht die Problematik Resistenzentwicklung und Antibiotikaanwendung von verschiedenen Standpunkten, um so gemeinsam Lösungsansätze in den unterschiedlichen Sektoren entwickeln zu können. Das wird auch von den Tierärzten und Landwirten, mit denen ich über das Projekt spreche, sehr positiv aufgenommen.
Welche konkreten Ziele hat Ihr Arbeitsbereich in dem Projekt?
Bisher gibt es noch keine Studien in Deutschland, die gezielt die Risikowahrnehmung zum Thema Antibiotikaresistenzen und multiresistente Erreger bei Tierärzten und Landwirten interaktiv untersuchen. Für uns ist es deshalb wichtig, erst einmal herauszufinden, wie die Thematik im Sektor Landwirtschaft und Tiermedizin betrachtet wird und wie informiert die Beteiligten sind. Ein weiterer Schwerpunkt besteht darin, zu untersuchen ob in diesem Bereich Kommunikationsbarrieren zwischen Tierärzten und Landwirten vorliegen und welche das sind. Durch die gezielte Entwicklung von Tools sollen diese ermittelten Barrieren überwunden werden, um so einen gezielten Antibiotikaeinsatz zu unterstützen.
Interview mit Dr. Markus Lehmkuhl, Institut für Publizistik und Kommunikationswissenschaft der Freien Universität Berlin
Herr Lehmkuhl, Sie haben eine Naturwissenschaft studiert und als Journalist über Naturwissenschaften berichtet. Jetzt untersuchen Sie wissenschaftlich, wie Wissenschaft kommuniziert wird. Was ist daran das Spannende?
Mich interessiert das Zusammenspiel zwischen Wissenschaft und Gesellschaft. Und Wissenschaftskommunikation ist das Instrument, das diese beiden Welten zusammenbringt. Lange saß die Wissenschaft ja im vielzitierten Elfenbeinturm. Das hat sich glücklicherweise geändert. Wissenschaftskommunikation ist wichtig geworden und wird immer wichtiger. Auch weil Politik und Gesellschaft zunehmend Einfluss auf die Wissenschaftsgenese nehmen, also darauf, was Wissenschaftler machen und erforschen.
Und was genau erforschen Sie und Ihre Kollegen am Institut für Kommunikation?
Wir untersuchen, inwieweit das, was die Wissenschaft öffentlich kommuniziert, gedeckt ist durch das, was wissenschaftlich erforscht ist.
Ist es nicht selbstverständlich, dass Aussagen aus der Wissenschaft auch wissenschaftlich belegt sind?
Das sollte man eigentlich annehmen. Da die Wissenschaft heute sehr viel mehr kommuniziert und sich in der Öffentlichkeit auch verkaufen muss, besteht die Gefahr, selbst zu tun, was eigentlich immer den Medien vorgeworfen wird. Nämlich die Fakten zu verzerren und Halbwahrheiten zu verbreiten, um damit für Aufmerksamkeit zu sorgen. Viele Menschen schauen in der Überzeugung auf die Wissenschaft, dass sie von dort ausschließlich Erkenntnisse geliefert bekommen. Was sie aber tatsächlich oft bekommen, sind vor allem Interessen.
Geben Sie doch bitte ein Beispiel?
Das Nichtrauchen. Bei diesem Thema ist die gesamte Kommunikation darauf ausgerichtet, einen erwünschten gesellschaftlichen Effekt erzielen – nämlich dass möglichst wenige Menschen rauchen. Aus medizinisch-gesundheitlicher Sicht mag das sinnvoll sein. Aus kommunikationswissenschaftlicher Perspektive ist das aber problematisch, weil dadurch die Glaubwürdigkeit der gesamten Wissenschaft leidet.
Wie können Wissenschaftler denn kommunizieren, um das zu verhindern?
Die Wissenschaft sollte nur die Faktenlage darstellen, die Wirkung muss dabei egal sein. Der Effekt einer Kommunikationsmaßnahme darf kein Referenzpunkt sein. Entscheidend ist, dass die kommunizierten Botschaften und Informationen wissenschaftlich gedeckt, verständlich und relevant sind. Was die Medien oder die Politik daraus machen, steht auf einem anderen Blatt. Darauf hat die Wissenschaft dann keinen Einfluss mehr.
Über Antibiotika und antibiotikaresistente Erreger wird in Politik und Medien in letzter Zeit ziemlich viel gesprochen – sogar auf dem G7-Gipfel im Juni 2015. Ein Indiz dafür, wie wichtig das Thema ist?
In Deutschland sind die Antibiotikaresistenzen erst auf dem Weg, ein wirklich großes Thema zu werden. Anders als bei "big issues" wie dem Klimawandel, gab es bei den Antibiotika bislang keine starke Politisierung. Die beginnt sich bei uns aber gerade zu entwickeln, erkennbar zum Beispiel daran, dass Angela Merkel die Resistenzproblematik auf die Agenda des G7-Gipfels gesetzt hatte. In Großbritannien hat die Politisierung schon stattgefunden, dort war der Kampf gegen Antibiotikaresistenzen sogar Wahlkampfthema.
Welche Folgen hat das, auch im Hinblick auf die Kommunikation?
Die Politisierung erhöht die Bedeutung des Themas und bringt es in der öffentlichen Wahrnehmung weit nach vorne. Durch den G7-Gipfel und die damit verbundene Berichterstattung haben die Antibiotikaresistenzen sehr viel Aufmerksamkeit bekommen, auch bei Menschen, die von dieser Problematik bis dahin nichts oder nur sehr wenig wussten. Und je größer die Bedeutung eines Themas in der Öffentlichkeit, desto wichtiger wird es, dieses Thema auch richtig zu kommunizieren. Das ist bei den Antibiotika aber gar nicht so einfach.
Wo liegen denn die Tücken?
Bei den Antibiotikaresistenzen stehen wir vor einer Gefährdungslage, über die naturgemäß vieles nicht bekannt ist. Denn genau wie beim Klimawandel geht es oft um Sachverhalte, die in der Zukunft passieren beziehungsweise passieren könnten. Was dann kommuniziert wird, sind Prognosen, die unterschiedlich gut begründet sein können. Ob diese Vorhersagen aber tatsächlich eintreten, kann niemand mit hundertprozentiger Sicherheit sagen. Das ist das große Dilemma, in dem man sich beim Thema Antibiotika befindet. Wie man die relevanten Botschaften an die Öffentlichkeit vermitteln und dabei gleichzeitig den Geboten der Wissenschaftlichkeit Rechnung tragen kann, möchten wir im RAI-Projekt herausfinden.
Wie gehen Sie und Ihre Kollegen da vor?
Wir machen drei Dinge: Erstens erheben wir, was in der Öffentlichkeit von wem über Antibiotika gesagt wird. Dann schauen wir, was dazu in der medizinischen Fachliteratur zu finden ist. Und im dritten Schritt untersuchen wir, ob und inwieweit beides zusammenpasst. So wollen wir zu Maßzahlen kommen, die angeben, wie gut eine Aussage wissenschaftlich belegt ist. Wir bezeichnen das als Evidence Mapping.
Das klingt recht abstrakt. Was für eine Aussage könnte das denn sein?
Zum Beispiel, dass es einen ursächlichen Zusammenhang zwischen dem zunehmenden Antibiotikaeinsatz in der Tiermast und Infektionen mit multiresistenten Erregern bei Patienten in Krankenhäusern gibt. Die Aussage zerlegen wir zunächst in einzelne Aspekte – wie den Antibiotikaverbrauch in der Tiermast oder die Übertragungswege der MRE vom Tier auf den Mensch. Dann wird geschaut, welche Studien es zu den jeweiligen Aspekten gibt. Es handelt sich also zunächst um eine reine Analyse. Die Erkenntnisse fließen dann aber in die Entwicklung der Kommunikations- und Informationstools, die bei RAI in der Interventionsphase eingesetzt werden.
Mit welchen Erkenntnissen rechnen Sie und was für Tools könnten das denn sein?
In einer einzigen Aussage zu Antibiotikaresistenzen kann ein Zusammenhang relativ sicher sein, während ein anderer Aspekt wissenschaftlich wesentlich weniger gut belegt ist. Die Botschaften sind also ambivalent, komplex und deshalb schwierig zu vermitteln. Die Herausforderung besteht darin, sehr viel Wissen so weit zu verdichten, dass der Kenntnisstand korrekt und verständlich dargestellt wird. Da müssen wir neue Wege beschreiten. Zum Beispiel mit Info-Grafiken, die die Zusammenhänge und die wissenschaftliche Evidenz visualisieren.
Welche Erwartungen verbinden Sie mit RAI?
In erster Linie geht es natürlich darum, durch Information und Kommunikation den rationalen Einsatz von Antibiotika in den Interventionsregionen zu fördern. Darüber hinaus würde ich mir aber wünschen, dass die in RAI entwickelten Maßnahmen und Instrumente auch eine gewisse Vorbildfunktion haben. Also dass das Thema Antibiotika nicht alarmistisch und sensationsheischend, sondern neutraler und wissenschaftlich gedeckt an die Öffentlichkeit kommuniziert wird.
Ein Interview mit Prof. Mathias Pletz, Leiter des Zentrums für Infektionsmedizin und Krankenhaushygiene (ZIMK) am Universitätsklinikum Jena.
Herr Pletz, angeblich wollten Sie schon als Student Infektiologe werden, nachdem sie Richard Prestons Tatsachen-Thriller über Ebola-Viren gelesen haben. Was fasziniert Sie so an diesem medizinischen Fachgebiet?
Als Infektiologe kann man bei Patienten mit akuten Infektionen unmittelbare und ursächliche Heilungserfolge erzielen, ähnlich wie beispielsweise auch Chirurgen. Da wir es insbesondere im Krankenhaus aber zunehmend mit Bakterien zu tun haben, die gegen eines oder mehrere Antibiotika resistent sind, verlieren unsere wirksamsten Waffen leider mehr und mehr an Schlagkraft.
Strategien gegen Infektionen mit antibiotikaresistenten Erregern zu entwickeln und umzusetzen, ist ein Schwerpunkt des Zentrums für Infektionsmedizin und Krankenhaushygiene. Was genau machen Sie und Ihre Kollegen dort?
Das ZIMK entstand 2013 aus der Sektion Klinische Infektiologie, der BMBF-Forschergruppe Infektiologie und der Abteilung für Krankenhaushygiene mit dem Ziel, die klinisch-infektiologische Expertise zu bündeln. In der gesamten Uniklinik und in einer Spezialambulanz betreuen wir Patienten mit verschiedensten Infektionskrankheiten nach dem neusten Stand der Wissenschaft. Weil das optimale Management von Infektionen ein interdisziplinäres Vorgehen verlangt, arbeiten wir dabei eng mit anderen Bereichen zusammen. Darüber hinaus versuchen wir, klinische Prozessabläufe stetig zu verbessern und so die Rate im Krankenhaus erworbener Infektionen zu verringern.
Wenn ein Arzt an der Uniklinik einen Infektpatienten betreut, der eventuell ein Antibiotikum braucht, kann er im ZIMK anrufen und bekommt dann binnen kurzer Zeit Unterstützung von einem Experten. Sollte es solche Einrichtungen nicht an allen Krankenhäusern geben?
Das dürfte schwierig werden. In ganz Thüringen gibt es derzeit drei stationär tätige Fachärzte für Infektiologie – und das auf 20.000 Krankenhausbetten. Ich denke zwar nicht, dass jedes Krankenhaus unbedingt einen Infektiologen braucht. Es ist aber auf jeden Fall ein Defizit, dass wir in Deutschland so wenig Spezialisten für Infektionskrankheiten haben. Das gilt auch für Fachärzten für Hygiene, von denen gibt es auch nur sehr wenige.
Laut Hygieneverordnung muss bis 2016 jedes Krankenhaus ab 400 Betten einen Krankenhaushygieniker beschäftigen. Wie will man diesen Bedarf denn decken?
Wegen der Verordnung wurde eine zweijährige Zusatzausbildung aus dem Boden gestampft, in der jeder klinische Facharzt Krankenhaushygieniker werden kann. Da etwa 1.200 Krankenhäuser einen Hygieniker brauchen, besteht auch große Nachfrage. Zur Ausbildung gehört aber eine Hospitanz bei einem der wenigen klinisch tätigen Fachärzte für Hygiene. Das ist das Nadelöhr, denn da haben wir momentan eine Wartezeit von zwei Jahren.
Sie haben lange als Intensivmediziner gearbeitet. Auf Intensivstationen sind Infektionen mit multiresistenten Erregern besonders häufig. Woran liegt das?
Das hat verschiedene Ursachen. Da die Patienten dort sehr schwer krank sind, ist ihr Immunsystem in der Regel geschwächt. Viele von Ihnen liegen im künstlichen Koma, werden beatmet und mit invasiven Methoden wie einem zentralen Venenkatheter behandelt. Alles Faktoren, die das Risiko einer nosokomialen Infektion – also einer im Krankenhaus erworbenen Infektion – steigern. Hinzu kommt, dass auf Intensivstationen der Antibiotikaverbrauch überproportional hoch ist. Und je mehr Antibiotika man einsetzt, desto größer ist die Wahrscheinlichkeit, dass sich Resistenzen entwickeln.
Dass Patienten im Krankenhaus krank sind und entsprechend behandelt werden, lässt sich ja nicht ändern. Um die Ausbreitung resistenter Erregern zu verhindern, müsste also der Antibiotikaverbrauch reduziert werden?
Eigentlich ja, aber das geht nicht so ohne weiteres. Aufgrund des demografischen Wandels gibt es immer mehr ältere Menschen, die mit fortschrittlichen Methoden behandelt werden, also beispielsweise ein künstliches Hüftgelenk bekommen. Diese Patienten haben nun einmal ein hohes Infektionsrisiko. Und wenn sie eine Infektion entwickeln, brauchen sie eine Antibiotikatherapie, denn sonst sterben sie. Wir werden also künftig eher noch mehr Antibiotika einsetzen, ohne dass wir viel dagegen unternehmen könnten.
Welche Möglichkeiten im Kampf gegen multiresistente Erreger (MRE) bleiben dann noch?
Es gibt zwei entscheidende Stellschrauben, an denen wir drehen können. Die eine ist, die Selektion von multiresistenten Erregern zu verringern, indem wir Antibiotika klug einsetzen. Das heißt möglichst kurz, möglichst schmal und nur, wenn es wirklich notwendig ist.
Und die zweite?
Wenn im Krankenhaus eine Infektion mit MRE auftritt, was sich nie vollständig verhindern lässt, dann muss man durch entsprechende Hygienemaßnahmen dafür sorgen, dass sie sich nicht von Patient zu Patient ausbreitet. Hygiene und Antibiotic Stewardship gehen somit Hand in Hand.
Antibiotic Stewardship, dieser Begriff fällt oft beim Thema Antibiotikaresistenzen. Was genau verbirgt sich dahinter?
Unter Antibiotic Stewardship, kurz ABS, werden Bemühungen und Maßnahmen zusammengefasst, die einer Verbesserung der Antibiotika-Verordnungspraxis dienen, und zwar sowohl in der ambulanten als auch in der stationären Versorgung. Ganz konkret im Krankenhausalltag am Patientenbett bedeutet das beispielsweise zu entscheiden, wo sich Antibiotika einsparen lassen, ohne den Patienten zu gefährden. Die wesentlichen Eckpunkte der ABS-Programme sind in der S3-Leitlinie zur rationalen Antibiotikaanwendung im Krankenhaus festgelegt.
Wer ist für die Umsetzung verantwortlich?
Leider gibt es im Moment Diskussionen, in wessen Zuständigkeit das Antibiotic Stewardship und die Ausbildung von ABS-Experten gehört – sowohl Apotheker und Mikrobiologen als auch die Deutsche Gesellschaft für Krankenhaushygiene sehen hier ihre Zuständigkeit. Aufgebaut wurde das ABS-Programm in Deutschland aber durch die Freiburger Infektiologen. Allerdings können deren Kurse nicht den Ausbildungsbedarf decken und es bestehen lange Wartelisten.
Was wäre Ihrer Ansicht nach die sinnvollste Lösung?
Wir brauchen ABS-Experten nicht nur an Unikliniken, sondern an allen Krankenhäusern. Doch dafür haben wir bei weitem nicht genug Infektiologen und Fachärzte für Hygiene. Nahe liegend wäre deshalb, dass klinische Fachärzte, die die Zusatzausbildung zum Krankenhaushygieniker gemacht haben, das gleich mit übernehmen. Zumal sie die klinische Erfahrung, die es braucht, um den Zustand eines Patienten zu beurteilen, häufig gleich mitbringen. Allerdings ist derzeit nicht klar, in welchem Umfang und durch wen eine zertifizierte ABS-Weiterbildung erfolgen kann.
Welchen Ausweg könnte es geben?
Ich würde mir wünschen, dass die Fachgesellschaften sich an einen Tisch setzen und klar sagen, dass sie beim Antibiotic Stewardship zusammenarbeiten und die ABS-Experten auch gemeinsam ausbilden. Ganz generell lässt sich die Problematik der Antibiotikaresistenzen nur dann lösen, wenn alle Beteiligten an einem Strang ziehen, vom Hygieniker über den Intensivmediziner bis hin zu Tierärzten, Landwirten und – ganz wichtig – den Patienten. Genau das ist ja die Intention von RAI. Deshalb freue ich mich, dass wir vom Universitätsklinikum Jena an dem Projekt beteiligt sind.
Herr Gensichen, Sie leiten das Institut für Allgemeinmedizin und haben in diesem Gebiet auch ihren Facharzt gemacht. Wie kommt man als Arzt zur Allgemeinmedizin und was genau macht man damit?
Der Allgemeinmediziner ist eine fünf Jahre dauernde Weiterbildung, die Ärzte direkt nach dem Studium beginnen können. Mit der Facharztprüfung hat man dann die Berechtigung, eine eigene hausärztliche Praxis zu führen – und die meisten Allgemeinmediziner arbeiten auch als Hausärzte. Ein interessanter neuer Trend ist, dass zunehmend Mediziner, die lange in einem anderen Fachgebiet tätig waren, den Facharzt für Allgemeinmedizin nachholen, um dann Hausarzt zu werden. Offenbar wird die vielfältige Tätigkeit als Hausarzt gerade wieder attraktiver.
Was ist denn das Attraktive daran? Sie haben ja selbst jahrelang als Allgemeinmediziner in einer Praxis gearbeitet.
Stimmt, und manchmal tut es mir ein bisschen Leid, dass ich jetzt als Hochschullehrer nicht mehr dazu komme. Reizvoll ist auf jeden Fall die Vielfalt der Krankheitsbilder, mit denen sich Allgemeinmediziner beschäftigen. Das Spannendste finde ich aber, dass man als Hausarzt seine Patienten oft über Jahre oder sogar Jahrzehnte begleitet und dabei alle Aspekte, die Gesundheit bestimmen, gemeinsam gestalten kann – von der Früherkennung, über chronische Erkrankungen bis zum Lebensstil. Es ist einfach der ärztliche Beruf, der am nächsten am Menschen dran ist.
Der Hausarzt ist damit nicht nur für jeden seiner Patienten wichtig, sondern für das gesamte Gesundheitssystem?
Ganz genau. Er ist der „Erste-Linie-Arzt“. Menschen, die ein gesundheitliches Problem haben, egal welches, können damit immer als erstes zum Hausarzt gehen. Falls nötig, überweist er sie weiter zum Facharzt oder ins Krankenhaus. Von dort kommen sie dann wieder in die hausärztliche Praxis zurück. Meist ist das Überweisen aber gar nicht erforderlich, denn über 80 Prozent aller gesundheitlichen Anliegen beim Hausarzt können auch durch ihn geklärt und behandelt werden.
Dazu gehören sicherlich die Infekte, mit denen Hausärzte gerade in den Wintermonaten ständig konfrontiert sind?
Die Hauptarbeit des Hausarztes ist die Betreuung von Patienten mit chronischen Erkrankungen wie Asthma oder Diabetes. Auch dabei spielt die Infektionsmedizin eine wichtige Rolle, etwa wenn ein Diabetiker eine Wunde am Fuß hat, die sich infizieren kann. Menschen mit schweren Grunderkrankungen sind eben oft besonders infektanfällig. Außerdem hat der Hausarzt bei seinen eigentlich gesunden Patienten natürlich viel mit den klassischen akuten Infektionen zu tun, also mit Infekten der oberen Atemwege oder einer Blasenentzündung.
Hausärzten wird vorgeworfen, dann vorschnell beziehungsweise unnötigerweise ein Antibiotikum zu verordnen und damit die Entwicklung antibiotikaresistenter Krankheitserreger zu fördern. Wie schätzen Sie das ein?
Wir Allgemeinmediziner sind maßgeblich an der Resistenzproblematik beteiligt, und darüber sollten wir uns klar sein! Da Hausärzte mit Abstand die meisten Patienten behandeln, verschreiben sie zwangsläufig die meisten Antibiotika. Und je mehr Antibiotika man einsetzt, desto größer ist die Gefahr, dass Bakterien resistent werden. Schuldzuweisungen bringen uns aber nicht weiter. Stattdessen sollten wir die Hausärzte dabei unterstützen, nur dann eine Antibiotikatherapie anzuordnen, wenn es wirklich notwendig ist.
Woran liegt es denn, dass Hausärzte damit offenbar Schwierigkeiten haben?
Eine der Ursachen ist ein unangebrachtes Sicherheitsdenken nach dem Motto: „Mehr wirkt mehr". Wenn Patienten mit chronischen Grunderkrankungen zusätzlich einen Infekt bekommen, haben Hausärzte oft Angst, sie ohne Antibiotika zu lassen – weil diese Menschen eben schon krank sind, um sozusagen auf Nummer sicher zu gehen. Und dies obwohl eine symptomatische Behandlung ausreicht, insbesondere wenn es sich um eine Virusinfektion handelt.
Was wäre denn in solchen Fällen der bessere Weg?
Ganz generell ist es bei einfachen Infektionen, z.B. der oberen Atemwege, oft sinnvoll, erst einmal zwei drei Tage abzuwarten und rein symptomatisch zu behandeln. Dann kann der Arzt im Verlauf beurteilen, ob weiterer Handlungsbedarf besteht oder nicht, weil der Infekt eventuell schon wieder abklingt. Anders als beispielsweise auf einer Intensivstation ist dieses zurückhaltende Vorgehen in der allgemeinmedizinischen Praxis auch möglich, ohne die Patienten damit massiv zu gefährden. Dass Hausärzte nicht aus unangebrachtem Sicherheitsbedürfnis Antibiotika verschreiben, ist ein ganz entscheidender Punkt bei der rationalen Anwendung dieser so wichtigen Medikamente.
Sind es nicht häufig die Patienten selbst, die von ihrem Arzt Antibiotika einfordern?
Tatsächlich denken sehr viele Menschen, dass bei Infekten sofort ein Antibiotikum genommen werden muss, selbst bei einem ganz gewöhnlichen Schnupfen. Das stimmt zwar überhaupt nicht, gerade in der Hausarztpraxis, wo Viren das Gros der Infektionen verursachen. Trotzdem erwarten die Patienten, dass der Arzt ihnen bei einem Infekt ein Antibiotikum verschreibt, weil dieser Link noch in ihrem Kopf fest verankert ist. Hausärzte müssen also nicht nur erkennen, wenn keine Antibiotikatherapie erforderlich ist, sie müssen dies dem Patienten dann auch überzeugend vermitteln.
Würden alle Hausärzte diese Überzeugungsarbeit leisten, müsste der Irrglaube "Infekt gleich Antibiotika" doch binnen kürzester Zeit verschwunden sein. Woran scheitert das?
Oft am Zeitmangel. Um den Link zu löschen, muss der Arzt dem Patienten zunächst die Diagnose erklären. Dann sollte er sich in Ruhe anhören können, was der Patient jetzt denkt und warum er ein Antibiotikum haben möchte. Im dritten Schritt erläutert er dann seinem Patienten, warum Antibiotika jetzt nicht nötig sind und was man stattdessen therapeutisch machen kann. Weil Hausärzte in Deutschland aber nur durchschnittlich acht Minuten für einen Patienten haben, muss dieses Gespräch schnell sein, damit es trotz des Zeitdrucks gelingt, die Antibiotikaproblematik stets anzusprechen.
Die Lösung wäre doch, den Ärzten mehr Zeit zu geben?
Das wäre grundsätzlich gut, lässt sich aber nicht so ohne weiteres umsetzen. Das ist ein langer Weg. Einfacher ist, den Hausarzt beim Gespräch über Antibiotika mit kurzen Leitfäden und speziellen Kurz-Info-Materialien zu unterstützen. Dabei kommt es auf die richtige Informationsdosis an. Komplexe Wirkweisen, seltene Sub-Spezifizierungen von Bakterien oder die komplexen Mechanismen der Resistenzentwicklung sind für den Patienten nicht wirklich relevant. Er muss aber wissen, wie er am besten wieder gesund wird und was er dafür tun sollte. Die Informationen, die er bekommt, sollten deshalb handlungsorientiert sein.
Information und Kommunikation stehen im Mittelpunkt des Modellprojekts RAI, an dem das Institut für Allgemeinmedizin beteiligt ist. Ist eine bessere Informationsvermittlung der Schlüssel zum rationalen Einsatz von Antibiotika?
Ich denke schon. Deshalb sind wir bei dem Projekt auch dabei. Was beim Umgang mit Antibiotika wissenschaftlich richtig und wichtig ist, steht ja längst fest. Das Problem ist aber, dass dem Hausarzt diese Informationen nicht in einer brauchbaren Weise zur Verfügung stehen und dass er sie auch nicht in einer brauchbaren Weise an seinen Patienten weitergeben kann. Der Transfer von den Websites, den Büchern, den Fachmagazinen in die Hausarztpraxis und ins Gespräch mit den Patienten fehlt.
Können Sie die Rolle Ihres Instituts bei RAI kurz beschreiben?
Wir am Institut für Allgemeinmedizin haben ein sehr gute Vorstellung davon, wie unsere niedergelassenen Kollegen arbeiten und lernen. Deshalb können wir einiges zum besseren Wissenstransfer in die Hausarztpraxen beitragen. Weil Hausärzte die meisten Menschen behandeln, haben sie beste Möglichkeiten, beim rationalen Antibiotikaeinsatz sehr viel zu bewegen. Und das eigentlich mit wenigen kleinen Veränderungen, wie mit einer effektiveren Kommunikation mit den Patienten über die Behandlung von Infekten.
Wie beurteilen Sie die Chancen, dass RAI zu einem vernünftigeren Umgang mit Antibiotika führen und so die Resistenzentwicklung eindämmen kann?
Für RAI haben sich erstmals Vertreter aus verschiedenen, für einen rationalen Antibiotikaeinsatz relevanten Bereichen zusammengeschlossen. Die Resistenzproblematik braucht einen breiten Zugang. Deshalb bin ich sehr zuversichtlich, dass wir mit diesem interdisziplinären Projekt wirklich etwas voranbringen können.
Herr Eckmanns, Sie leiten am Robert Koch-Institut (RKI) das Fachgebiet „Nosokomiale Infektionen, Surveillance von Antibiotikaresistenz und –verbrauch“. Wie kommt es, dass Sie als Arzt nicht in der Patientenversorgung gelandet sind, sondern bei einem Bundesinstitut?
Infektionskrankheiten haben mich schon im Studium interessiert, deshalb wollte ich eigentlich Tropenmediziner werden. Mit der Idee, erst alles Wichtige über Infektionen zu lernen, um anschließend in den Tropen zu arbeiten, kam ich ans Institut für Hygiene und Umweltmedizin in Berlin. Dort habe ich meinen Facharzt gemacht und per Fernstudium in London noch einen Master in Epidemiologie. Statt nach Afrika oder Asien bin ich dann allerdings ans Robert Koch-Institut gegangen, weil ich mehr Public Health machen wollte.
Am RKI widmen Sie sich ebenfalls der Bekämpfung von Infektionskrankheiten, wenn auch in einem wesentlich größeren Kontext. Was fasziniert Sie an diesem Gebiet so sehr?
Dass das Verhalten der Menschen dabei so wichtig ist. Wie man sich verhält, spielt bei vielen Krankheiten eine Rolle, allerdings vor allem für den Erkrankten selbst. Bei den Infektionen wirkt sich das Verhalten auch auf das Erkrankungsrisiko anderer aus, weil es sich um übertragbare Erkrankungen handelt. Durch Verhaltensänderungen lassen sich Infektionskrankheiten beziehungsweise deren Ausbreitung verhindern. Bei Ebola war das zu sehen. Liberia hat den Ausbruch 2014 deswegen von allen in Westafrika betroffenen Regionen am schnellsten in den Griff bekommen, weil die Bevölkerung besser involviert wurde als in anderen Ländern. Infektionen sind ein sozialmedizinisches Thema und das macht sie für mich so spannend.
Während des Ebola-Ausbruchs haben Sie bei der WHO gearbeitet und waren mehrere Monate vor Ort in Sierra Leone. Jetzt sind Sie wieder zurück in Berlin und beschäftigen sich mit Krankenhausinfektionen. Ist das nicht vergleichsweise langweilig?
Nein, überhaupt nicht! Obwohl ich mich natürlich freue, dass mein Studententraum, für längere Zeit nach Afrika zu gehen, sich endlich erfüllt hat. Nosokomiale Infektionen und resistente Erreger verursachen in Deutschland eine große Krankheitslast. Viele schwerwiegende Infektionskrankheiten wurden hierzulande zurückgedrängt oder ganz beseitigt. Für die Krankenhausinfektionen gilt dies jedoch nicht, was auch daran liegt, dass die Menschen immer älter werden und wir Patienten mit schweren Erkrankungen immer besser behandeln können. Die Gründung des von mir geleiteten neuen Fachgebiets am RKI war eine Reaktion darauf, dass nosokomiale Infektionen und Infektionen mit resistenten Erregern ein zunehmendes Problem darstellen.
Ein Problem, das noch verstärkt wird, weil immer mehr Infektionserreger gegen ein oder mehrere Antibiotika unempfindlich sind?
Ende der 1960er Jahre verkündete ein hochrangiger US-Gesundheitsexperte, das Buch der Infektionskrankheiten könne geschlossen werden. Man habe diese Erkrankungen jetzt im Griff, vor allem dank der Antibiotika. Das war leider ein Irrtum. Infektionen gehören nach wie vor zu den großen Herausforderungen der Medizin, auch wegen der Zunahme antibiotikaresistenter Erreger. Die Situation wird inzwischen weltweit als sehr dramatisch angesehen. Deshalb stand die Resistenzproblematik beim letzten G7-Gipfel auf der Agenda und rückt auch am RKI mehr und mehr in den Mittelpunkt. Antibiotikaresistenzen sind ein Thema, mit dem wir uns als Public-Health-Institut in den nächsten Jahren unbedingt beschäftigen müssen.
Wie groß ist denn Ihrer Ansicht nach die Bedrohung durch antibiotikaresistente Krankheitserreger?
Ich finde, in der öffentlichen Darstellung wird manches übertrieben. So sagen einige Experten, dass wir vor einem postantibiotischen Zeitalter stehen, in dem wir keine wirksamen Antibiotika mehr haben, um Patienten mit Infektionen zu behandeln. Tatsächlich verursachen solche superresistenten Keime, die wirklich gegen fast alle Antibiotika unempfindlich sind, derzeit nur 0,01 Prozent der nosokomialen Infektionen in Deutschland. Von einem postantibiotischen Zeitalter sind wir also noch sehr weit entfernt. Natürlich müssen wir verhindern, dass die multiresistenten Erreger zunehmen. Übertreibungen und Panikmache bringen uns aber nicht weiter.
Eine Schwierigkeit ist offenbar, dass die multiresistenten Erreger vor Grenzen nicht Halt machen. So steht in der Teilvorhabenbeschreibung des RKI im RAI-Projekt, die zunehmende internationale Vernetzung durch Reiseverkehr und Handel habe zur Folge, dass sich neu auftretende Resistenzen innerhalb kürzester Zeit weltweit verbreiten können. Woran lässt sich das festmachen?
Dafür gibt es einige interessante Beispiele. Die Neu-Dehli Metallo-Beta-Laktamase ist ein Enzym, das zu einer Resistenz gegen Cabapeneme, das sind wichtige Reserve-Antibiotika, führt. Die ersten Bakterienstämme, die dieses Enzym produzieren, tauchten in Neu Dehli auf, daher der Name. Kurze Zeit später gab es sie auch in England. Forscher haben die Wege untersucht und herausgefunden, dass nicht wenige Menschen aus England für Operationen nach Indien fahren, vor allem für kosmetische Eingriffe. Diese Patienten bringen aber nicht nur eine neue Nase mit nach Hause, sondern zum Teil auch einen neuen multiresistenten Erreger.
Bemerken die infizierten Personen das denn nicht?
Nein, zumeist nicht, oder zumindest nicht sofort. Die Reisenden tragen die Keime zwar mit sich, oft im Darm, werden davon aber nicht krank. Das Tückische an den multiresistenten Erregern ist, dass sie übertragen werden, ohne Symptome zu verursachen. Deshalb können sie sich zunächst still ausbreiten. Irgendwann kommt es dann zu einer zunehmenden Zahl von Infektionen.
Ist Reisenden überhaupt bewusst, dass sie aus anderen Ländern Krankheitserreger einschleppen könnten, die dann sowohl sie selbst als auch andere in Gefahr bringen?
Das ist einer der Punkte, den das Teilprojekt des RKI bei RAI unter die Lupe nimmt. Mit einem Fragebogen identifizieren wir den Informationsbedarf und die Informationsbedürfnisse von Reisenden bei diesem Thema. Basierend auf den Ergebnissen werden wir dann gezielte Informationsmaterialien erstellen und Empfehlungen formulieren. Ich denke, im Moment wissen nur relativ wenige Menschen über den Zusammenhang zwischen Auslandsreisen und multiresistenten Erregern Bescheid.
Also müsste man Reisende besser informieren und ihnen sagen, worauf sie achten sollten. Woran scheitert das bisher?
Fernreisende lassen sich recht gut erreichen, weil sie vorab oft in eine Reiseambulanz zur medizinischen Beratung gehen. Von den Menschen, die zum Beispiel nach Griechenland reisen, macht das aber kaum jemand. Deshalb ist es schwierig, sie direkt über die Resistenzproblematik zu informieren. Dabei hat Griechenland eine hohe MRE-Rate. Das ist für die Reisenden jedoch nur ein Problem, wenn sie ins Krankenhaus müssen. Denn dort können sie sich dann sehr leicht einen multiresistenten Erreger einhandeln.
Wo könnte man noch ansetzen, wenn die Reisenden nicht so leicht erreichbar sind?
Ganz wichtig ist es, Ärztinnen und Ärzte dafür zu sensibilisieren, dass bei Patienten mit Infektionen, die in bestimmten Ländern waren, andere Erreger als üblich im Spiel sein könnten und dass es sich dabei möglicherweise um MRE handelt. Um im Beispiel zu bleiben: Wenn ein Patient zuvor einem griechischen Krankenhaus behandelt wurde, sollten beim Arzt die Alarmglocken klingeln.
Dies setzt aber voraus, dass der Arzt sich auch nach Auslandsaufenthalten erkundigt. Wird das denn immer gemacht?
Auch das wird in unserem RAI-Arbeitsschwerpunkt Reisemedizin näher untersucht. Zu einer ordentlichen Anamnese sollte die Frage nach der Reisetätigkeit immer dazugehören – sowohl beim Hausarzt als auch im Krankenhaus. Bislang haben wir den Ärzten gesagt, dass sie vor allem bei älteren, kranken Menschen oder auch bei bestimmten Berufsgruppen wie Schweinewirten an multiresistente Erreger denken sollten. Das müssen wir jetzt ausdehnen auf Reisende aus bestimmten Risikoländern. Ich finde es sehr gut, dass bei RAI Kommunikationsprofis mit an Bord sind. Denn das hilft uns sicherlich enorm dabei, Ärzte und Patienten so über das Thema Antibiotika und multiresistente Erreger zu informieren, dass die Botschaften auch ankommen. Information gehört zu den wichtigsten Maßnahmen im Kampf gegen Antibiotikaresistenzen.
Was erwarten Sie sich von RAI?
Dass alle relevanten Bereiche gemeinsam in einem Projekt sind, also die Ärzte, die Tiermediziner, die Hygieniker, die Infektiologen und mit dem RKI auch der öffentliche Gesundheitsdienst, das ist etwas Besonderes und extrem viel wert. Das macht mir Hoffnung, dass wir beim rationalen Einsatz von Antibiotika und gegen die Resistenzentwicklung wirklich etwas voranbringen können. Und ich freue mich auch persönlich darüber, bei RAI mit Experten aus den verschiedenen Sektoren zusammenzuarbeiten.
Publikationen
Folgende Teilergebnisse wurden bisher veröffentlicht:
-
Schneider S. et al. Antibiotikaeinnahme und Resistenzentwicklung - Wissen, Erfahrungen und Einnahmeverhalten innerhalb der deutschen Allgemeinbevölkerung. Bundesgesundheitsblatt 2016.
-
Lehmkuhl M. Herausforderungen der Vermittlung von Infektionsrisiken in der Öffentlichkeit - Nüchtern Informieren oder Alarmieren? Hygiene UpToDate. 2016.
-
Salm F. et al. Hausärzte müssen das Thema Antibiotika-Resistenzen angehen. MMW 2017.
-
Salm F. et al. Antibiotic prescribing behavior among general practitioners - a questionnaire-based study in Germany. BMC Infect Dis 2018.
-
Schneider S. et al. Perceptions and attitudes regarding antibiotic resistance in Germany: a cross-sectoral survey amongst physicians, veterinarians, farmers and the general public. J Antimicrob Chemother 2018.
-
Antão EM. et al. Antibiotic resistance, the 3As and the road ahead. Gut Pathog 2018.
-
Meurs L. et al. Intestinal colonization with extended-spectrum beta-lactamase producing Enterobacterales (ESBL-PE) during long distance travel: A cohort study in a German travel clinic (2016-2017). Travel Med Infect Dis 2019.
-
Boklage E., Lehmkuhl E. Coverage of Antimicrobial Resistance in the German Press: 1993-2013. Health Commun 2019.
-
Andres E. et al. Rationaler Antibiotikaeinsatz: Impulse für den hausärztlichen Versorgungsalltag (Symposium-Bericht). Zeitschrift für Allgemeinmedizin 2020.
-
Petruschke I. et al. Evaluation of a multimodal intervention to promote rational antibiotic use in primary care. Antimicrob Resist Infect Control 2021.
